/reboot/media/77ff2bd0-c400-11ee-abc4-0242ac12000a/909bec1c-1f4c-11ef-9876-0242ac120013/1-1-image-biosimilaires.png)
Les Biosimilaires : opportunités et défis pour l'industrie pharmaceutique
Avec une arrivée à la fois récente et imminente de nombreux biosimilaires sur le marché, l'industrie pharmaceutique est en pleine évolution. Ces médicaments, équivalents de produits biologiques originaux dont le brevet a expiré, présentent de nombreuses opportunités, mais aussi des défis considérables pour les différents acteurs de ce marché. Nous souhaitons explorer de manière impartiale l'importance croissante des biosimilaires, leur adoption, ainsi que les obstacles réglementaires et commerciaux auxquels ils sont confrontés.
Importance croissante des biosimilaires
Les biosimilaires, des produits biologiques similaires à des médicaments approuvés (produits de référence), jouent un rôle de plus en plus crucial dans le secteur pharmaceutique. Leur importance augmente à mesure que les brevets des médicaments biologiques originaux expirent, ouvrant ainsi la voie à des alternatives parfois plus abordables. Cette dynamique transforme le paysage pharmaceutique et offre des opportunités significatives pour les systèmes de santé et les patients.
Économies substantielles pour les systèmes de santé
L'un des principaux avantages des biosimilaires réside dans leur capacité à générer des économies substantielles. En réduisant les coûts des traitements biologiques, ils permettent aux systèmes de santé de réallouer des ressources vers d'autres domaines critiques. Une étude de l'Agence Européenne des Médicaments (EMA) démontre, par exemple, que l'introduction de biosimilaires en Europe a permis des économies allant jusqu'à 33 % par rapport aux coûts des médicaments biologiques de référence. (Le Moniteur des pharmacie.fr).
Amélioration de l'accès aux traitements
Les biosimilaires jouent également un rôle important dans l'amélioration de l'accès des patients aux traitements. Les coûts élevés des médicaments biologiques peuvent limiter l'accès pour de nombreux patients, notamment dans les pays à revenu faible ou intermédiaire, sans accès évident à une sécurité sociale. En offrant des alternatives moins coûteuse, les biosimilaires permettent à un plus grand nombre de patients de bénéficier de traitements vitaux. L'Organisation Mondiale de la Santé (OMS) soutient activement l'adoption des biosimilaires pour accroître l'accès aux médicaments et améliorer les résultats de santé mondiale (Pfizer France).
Impact sur l'innovation et la concurrence
L'arrivée des biosimilaires sur le marché semble également être un excellent stimulant pour l'innovation et la concurrence dans le secteur pharmaceutique. Les entreprises de biotechnologie sont incitées à développer de nouvelles solutions et à améliorer les médicaments existants pour maintenir leur avantage concurrentiel. Cette dynamique profite aux patients, car elle conduit à des traitements plus innovants et efficaces. .
Adoption des Biosimilaires
L'adoption des biosimilaires progresse rapidement à travers le monde, bien que le rythme et l'étendue de leur intégration varient considérablement selon les régions et les systèmes de santé. Plusieurs facteurs influencent cette adoption, notamment les politiques gouvernementales, les stratégies de remboursement et la perception des professionnels de santé et des patients.
Adoption en Europe
L'Europe est souvent citée comme un modèle en matière d'adoption des biosimilaires. Depuis l'approbation du premier biosimilaire par l'EMA en 2006, le marché européen des biosimilaires n'a cessé de croître. Actuellement, plus de 60 biosimilaires ont été approuvés dans l'Union Européenne, couvrant une variété de traitements allant de l'oncologie à la rhumatologie (Le Moniteur des pharmacie.fr).
Les politiques de soutien et les initiatives gouvernementales jouent évidemment un rôle crucial dans cette adoption. Par exemple, plusieurs pays européens, tels que l'Allemagne et le Royaume‑Uni, ont mis en place des programmes incitatifs pour promouvoir l'utilisation des biosimilaires. Ces programmes incluent des incitations financières pour les prescripteurs, des campagnes d'éducation pour les patients et des stratégies de remboursement favorables.
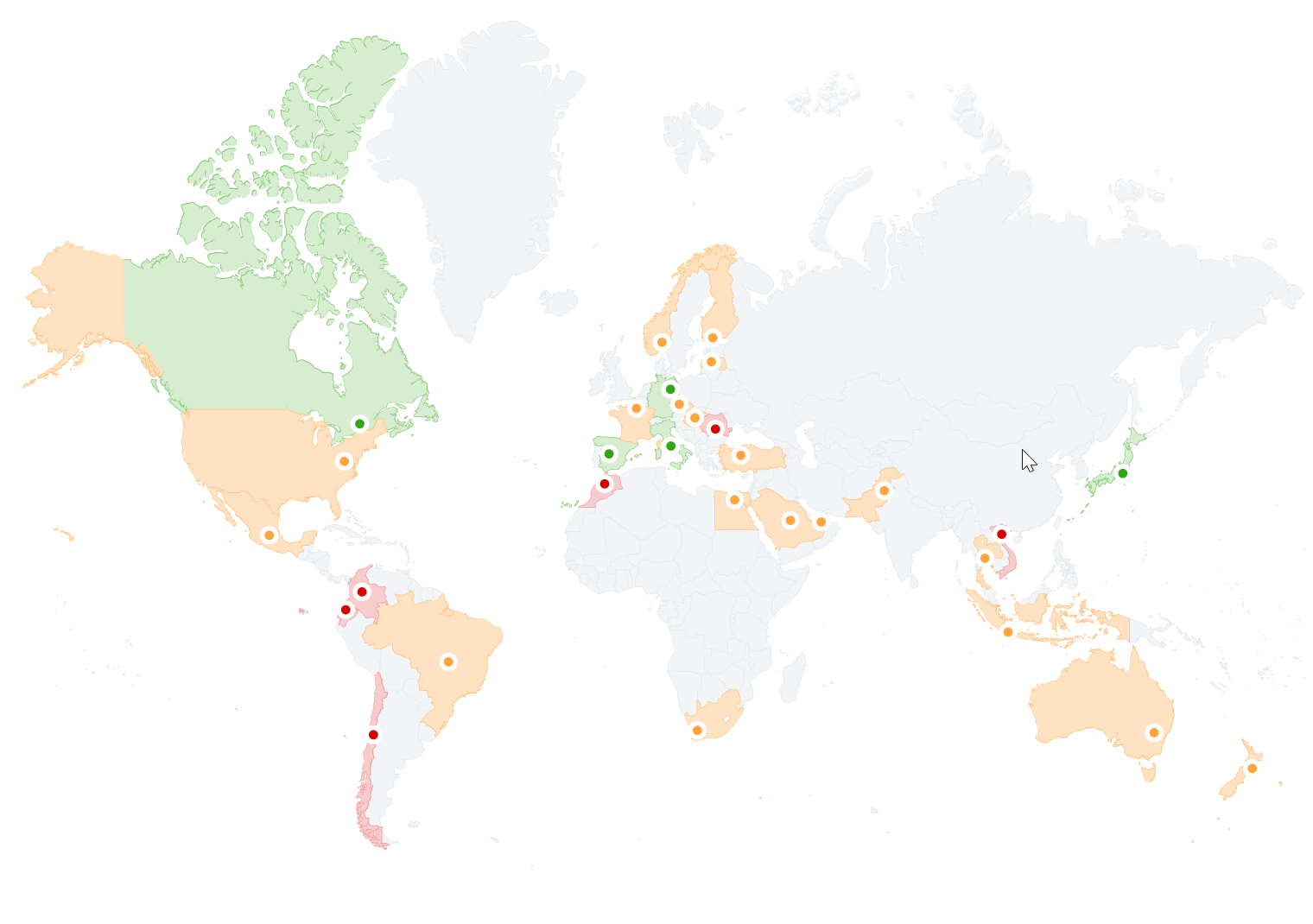
Carte de l'adoption des biosimilaires à travers le monde, cliquez sur l'image pour accéder à l'étude.
Adoption aux États‑Unis
Aux États‑Unis, le marché des biosimilaires est plus récent et son adoption a été plus lente comparée à l'Europe. Depuis l'approbation du premier biosimilaire par la FDA en 2015, le nombre de biosimilaires approuvés a dépassé la trentaine. Plusieurs obstacles semblent en effet avoir entravé leur adoption, notamment des litiges de brevets, les stratégies de "pay‑for‑delay" (paiement pour retarder l'entrée sur le marché) et les incertitudes concernant les politiques de remboursement (Pharmaceutiques).
Malgré ces défis, la situation évolue. Les récentes réformes politiques et les initiatives de la FDA visent à accélérer l'approbation des biosimilaires et à encourager leur utilisation. Les payeurs et les prestataires de soins de santé commencent à reconnaître les avantages économiques des biosimilaires, ce qui devrait stimuler leur adoption à l'avenir.
Perception des professionnels de santé et des patients
La perception des biosimilaires par les professionnels de santé et les patients est un facteur clé de leur adoption. Des études montrent que la méfiance initiale envers l'efficacité et la sécurité des biosimilaires diminue à mesure que l'expérience clinique s'accumule et que les preuves scientifiques se renforcent. Les campagnes d'information et les programmes de formation destinés aux professionnels de santé jouent un rôle important pour dissiper les réticences et en favoriser l'adoption.
En ce qui concerne les patients, l'acceptation des biosimilaires dépend souvent d'une communication efficace des professionnels de santé sur leur sécurité et leur efficacité. Les initiatives de sensibilisation et d'éducation des patients ET des professionnels de santé sont essentielles pour renforcer la confiance dans ces traitements.
Perspectives d’avenir
Avec l'expiration de nombreux brevets de médicaments biologiques phares, l'adoption des biosimilaires est appelée à croître. Cette dynamique est renforcée par les efforts concertés des régulateurs, des payeurs et des fabricants pour surmonter les obstacles actuels et promouvoir les avantages des biosimilaires dans un soucis de pallier aux problèmes d'approvisionnement. Le développement continu de politiques favorables et de programmes de soutien promet de faciliter davantage l'intégration des biosimilaires dans les pratiques cliniques et de maximiser leurs bénéfices pour les systèmes de santé et les patients.
Défis réglementaires
Les biosimilaires, bien qu'offrant des avantages considérables en termes de réduction des coûts et d'amélioration de l'accès aux traitements, doivent surmonter des défis réglementaires significatifs. Ces défis proviennent de la complexité inhérente à la production de ces médicaments biologiques et des exigences strictes imposées par les autorités de santé pour garantir leur sécurité et leur efficacité. Voici un aperçu des principaux défis réglementaires auxquels sont confrontés les biosimilaires.

Exigences d'autorisation de mise sur le marché
L'une des premières barrières pour les biosimilaires est l'obtention de l'autorisation de mise sur le marché (AMM). Contrairement aux médicaments génériques classiques, qui sont des copies chimiques exactes de leurs homologues de marque, les biosimilaires sont des produits biologiques complexes. En conséquence, les exigences pour prouver leur équivalence en termes de sécurité, d'efficacité et de qualité sont beaucoup plus élevées. Les fabricants doivent mener des études comparatives approfondies, incluant des essais cliniques, pour démontrer que leur produit est hautement similaire au produit de référence (Le Moniteur des pharmacie.fr).
En Europe, l'EMA a établi des lignes directrices strictes pour l'évaluation des biosimilaires, exigeant des données robustes issues de tests précliniques et cliniques. De même, la FDA aux États‑Unis impose des critères rigoureux pour l'approbation des biosimilaires, bien que les approches puissent différer légèrement entre les deux agences, créant des défis supplémentaires pour les entreprises cherchant des approbations multiples (Pfizer France).
Variabilité dans les règlementations internationales
La variabilité des règlementations internationales constitue un autre défi majeur. Chaque région ou pays peut avoir des exigences spécifiques pour l'approbation des biosimilaires, ce qui complique la stratégie de mise sur le marché pour les fabricants. Par exemple, certaines régions peuvent demander des études supplémentaires ou des types spécifiques de données cliniques, rendant le processus plus coûteux et long (Pharmaceutiques).
Cette hétérogénéité réglementaire peut également conduire à des délais de lancement différés, limitant ainsi l'accès rapide des patients aux traitements. Les entreprises doivent naviguer dans un paysage réglementaire complexe et s'adapter aux exigences locales pour chaque marché cible.
Démonstration de la similitude et de l'interchangeabilité
Les biosimilaires ont besoin de démontrer leur similitude avec le produit de référence et, dans certains cas, leur interchangeabilité. La similitude doit être prouvée à travers des études approfondies de qualité, de sécurité et d'efficacité. L'interchangeabilité, qui permet de substituer le biosimilaire au produit de référence sans consultation préalable du prescripteur, n'est pas automatiquement accordée et nécessite des preuves supplémentaires. Aux États‑Unis, par exemple, la FDA n'a jusqu'à présent accordé le statut d'interchangeabilité qu'à un nombre limité de biosimilaires.
Surveillance post‑mise sur le marché
La surveillance post‑mise sur le marché (pharmacovigilance) permet de garantir la sécurité continue des biosimilaires. Les autorités réglementaires exigent des plans de pharmacovigilance robustes pour détecter, évaluer et prévenir les effets indésirables potentiels. Cette surveillance est particulièrement importante pour les biosimilaires, car même des différences minimes dans les procédés de fabrication peuvent avoir des impacts significatifs sur la sécurité et l'efficacité du produit.
Coûts et temps de développement
Le développement des biosimilaires est coûteux et chronophage. Les essais cliniques et les études comparatives nécessaires pour répondre aux exigences réglementaires représentent un investissement financier considérable. De plus, les délais nécessaires pour obtenir les approbations peuvent retarder la mise sur le marché, impactant la rentabilité des entreprises. Selon un rapport de la Pharmaceutical Research and Manufacturers of America (PhRMA), le coût de développement d'un biosimilaire pourrait atteindre un cout de plusieurs centaines de millions de dollars.

Défis commerciaux
L'adoption sur le marché pharmaceutique des produits biosimilaires se heurte à plusieurs contraintes commerciales. Ces obstacles peuvent freiner leur déploiement et affecter la rentabilité des entreprises qui les produisent. Voici un examen détaillé de ces défis.
Éducation et sensibilisation des professionnels de santé
La sensibilisation et l'éducation des professionnels de santé sont essentielles pour l'adoption des biosimilaires. Cependant, il existe une certaine méfiance et une réticence à utiliser ces produits en raison de la complexité de leur développement et des différences perçues par rapport aux produits de référence. Les fabricants de biosimilaires doivent investir massivement dans des programmes éducatifs et des campagnes de sensibilisation pour convaincre les prescripteurs de la sécurité et de l'efficacité de leurs produits.
Les initiatives de formation doivent être continues et adaptées pour répondre aux préoccupations spécifiques des professionnels de santé. Par exemple, des sessions de formation en ligne, des webinaires, et des séminaires peuvent être organisés pour fournir des preuves cliniques et des données comparatives entre les biosimilaires et les produits de référence.
Politiques de remboursement et accès au marché
Les politiques de remboursement varient considérablement entre les pays et peuvent influencer fortement l'adoption des biosimilaires. Dans certains marchés, les biosimilaires peuvent ne pas bénéficier du même niveau de remboursement que les produits de référence, rendant leur adoption moins attractive pour les patients et les prescripteurs. Les fabricants de biosimilaires doivent naviguer dans ces politiques de remboursement complexes et travailler avec les autorités de santé pour s'assurer que leurs produits sont inclus dans les listes de médicaments remboursables (Pfizer France).
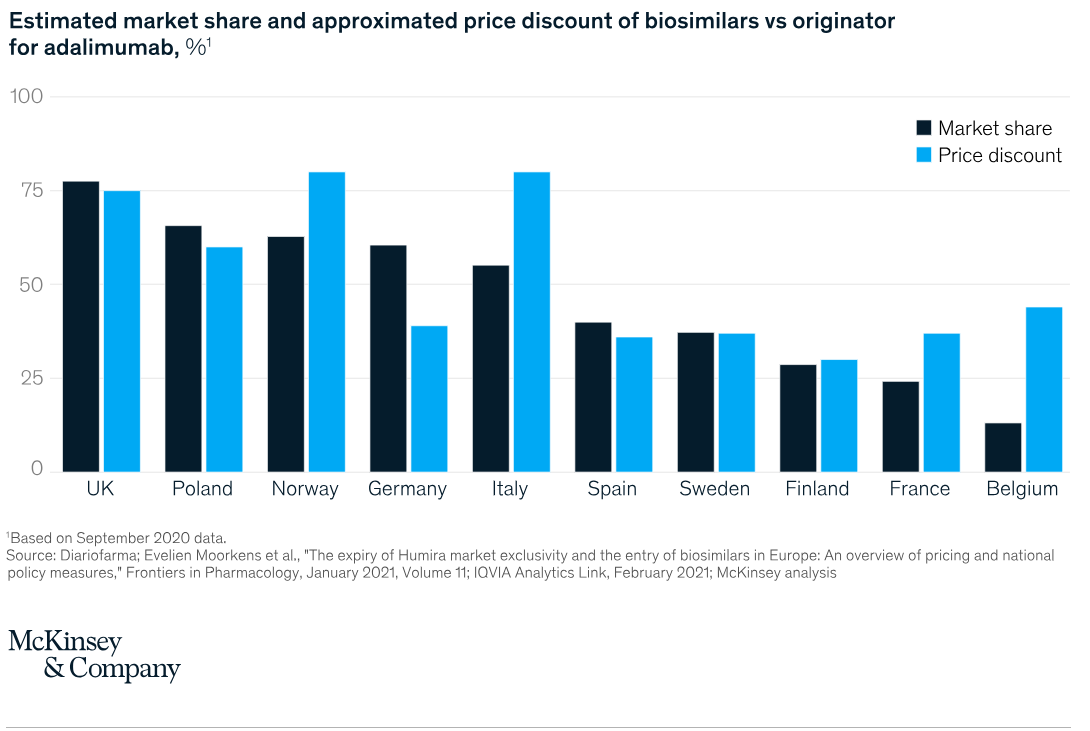
Comparaison des politiques de remboursement des biosimilaires à travers le monde - étude de McKinsey & Company - Accédez à l'étude en cliquant sur l'image.
Coûts de production et marges bénéficiaires
La production de biosimilaires est un processus coûteux et complexe. Les biosimilaires nécessitent des investissements importants en termes de recherche, de développement et de fabrication. Les entreprises doivent mettre en place des installations de production de haute technologie et se conformer à des normes de qualité rigoureuses. Ces coûts élevés peuvent réduire les marges bénéficiaires et rendre difficile la concurrence sur les prix avec les produits de référence et d'autres biosimilaires (Presse - Ministère des Finances).
Adoption par les patients
Enfin, l'adoption par les patients semble également être une barrière importante pour les acteurs de ce marché. La perception des biosimilaires par les patients peut affecter leur acceptation. Les patients peuvent être réticents à changer de traitement en raison de préoccupations concernant la sécurité et l'efficacité des biosimilaires. Les entreprises doivent donc investir dans des campagnes de sensibilisation et fournir des informations claires et convaincantes pour gagner la confiance des patients (Le Moniteur des pharmacie.fr).
En dépit des nombreux défis réglementaires et commerciaux, l'industrie des biosimilaires continue de croître, stimulée par la demande de traitements plus abordables et accessibles. Les entreprises qui réussissent à naviguer dans ce paysage complexe peuvent non seulement bénéficier de nouveaux marchés, mais aussi contribuer de manière significative à l'amélioration des soins de santé à l'échelle mondiale. La collaboration étroite avec les autorités de régulation et l'innovation dans les procédés de développement sont essentielles pour surmonter ces obstacles et maximiser le potentiel des biosimilaires.
Trouvez en Pharmafield un allié de taille
Que vous soyez un laboratoire développant des biosimilaires ou un fournisseur de produits de référence, Pharmafield se propose de vous aider à surmonter ces défis. Nous comprenons les complexités réglementaires, les coûts élevés de développement, et les stratégies de défense de marché qui peuvent impacter votre succès.
Vous rencontrez des obstacles avec vos biosimilaires ou produits de référence ? Laissez‑nous vous aider. Envoyez‑nous un email et nous vous rappellerons sous 2 heures.
Pharmafield s'engage à fournir des solutions personnalisées pour maximiser le potentiel de vos produits, qu'il s'agisse de biosimilaires ou de médicaments de référence, et d'assurer leur succès sur le marché. Notre expertise est à votre service pour vous accompagner dans chaque étape de votre stratégie commerciale.
:strip_exif()/reboot/media/77ff2bd0-c400-11ee-abc4-0242ac12000a/0f7612d6-5974-11ea-a4ee-0242ac130005/0-0-logo.png)
:strip_exif()/reboot/media/77ff2bd0-c400-11ee-abc4-0242ac12000a/0f7612d6-5974-11ea-a4ee-0242ac130005/0-0-logo.png)
/reboot/media/77ff2bd0-c400-11ee-abc4-0242ac12000a/dc200c4e-8d17-11ee-aae3-0242ac12000c/1-1-person-writing-on-white-notebook-ltnvqhdkkmw-jpg.jpg)
/reboot/media/77ff2bd0-c400-11ee-abc4-0242ac12000a/53bc3a3a-57b1-11ee-a53d-0242ac14000c/1-1-puff-2.jpg)
:strip_exif()/reboot/media/77ff2bd0-c400-11ee-abc4-0242ac12000a/2061c86c-8b42-11ed-b331-0242ac140009/1-1-logo-pharmafield.png)
:strip_exif()/reboot/media/77ff2bd0-c400-11ee-abc4-0242ac12000a/2da09cee-b9f2-11ee-a568-0242ac12000a/1-1-shutterstock-1928279876.png)